Инж. А. ЭТЕРМАН и инж. Э. ФУРМАН, Рисунки А. КАТКОВСКОГО
Вода — необходимое
для жизни вещество, поэтому неудивительно, что в древности считали воду тем
первоначальным элементом, из которого произошло все существующее. Еще несколько
тысячелетий назад было обнаружено ценное свойство воды — ее способность
образовывать растворы, которые облегчают взаимодействие различных веществ между
собою. Вот почему алхимики считали воду веществом совершенным. Современная
химий лишила воду того ореола, которым окружил ее древний мир, показав, что
вода является обычным сложным соединением атома кислорода с двумя атомами
водорода. Однако в последнее время обнаружилось, что вода может содержать
различные атомы водорода и различные атомы кислорода и что в зависимости от
этого меняются свойства воды.
Долго существовало мнение, будто все атомы одного и того же вещества неделимы. Но, исследуя строение атомов физическими методами, ученые опровергли это представление и сделали замечательное открытие: атомы состоят из целого ряда положительно и отрицательно заряженных частиц.
Впервые
расщепление атома наблюдал английский ученый Крукс. Он взял трубку, наполненную
сильно разреженным водородом. С обоих концов в трубку были впаяны две
металлические пластины. Одна из пластин была заряжена положительно (анод), а
другая — отрицательно (катод). Под действием электрического поля атомы водорода
в этой трубке расщеплялись, и Крукс наблюдал, как от катода перпендикулярно его
поверхности исходит поток быстро движущихся отрицательно заряженных частиц.
Увидеть движение положительных частиц атомов водорода Круксу не удалось.
В 1886 г.
немецкий физик Гольдштейн сделал в катоде ряд маленьких отверстий-каналов и
наблюдал в закатодном пространстве слабое свечение. Лучи этого свечения,
названные каналовыми, оказались потоком положительных частиц.
Если на пути
тонкого каналового луча поставить фотографическую пластинку, то в том месте,
где ее встретит луч, получится пятно. Но каналовый луч — это поток
положительных частиц, значит, он должен реагировать на электрические и
магнитные силы. И действительно, под действием этих сил луч отклоняется. Это
отклонение фиксирует фотографическая пластинка, на которой пятно смещается в
сторону. Величина и направление смещения зависят, при данных действующих силах,
во-первых, от отношения заряда частицы к ее массе и, во-вторых, от скорости частицы.
Если закатодный луч состоит из частиц, у которых отношение заряда к массе
различное и скорости которых не одинаковы, то на фотопластинке получится ряд
пятен, отклоненных в различных направлениях и на различные расстояния. Зная
массу, скорость и заряд частицы, можно подсчитать, насколько должна отклониться
эта частица под действием электрического или магнитного поля. С другой стороны,
по отклонению частицы можно определить ее массу.
Такой метод
определения атомных весов был впервые предложен знаменитым английским физиком
Дж. Дж. Томсоном и в дальнейшем значительно усовершенствован его учеником Ф.
Астоном. Изучая атомные веса целого ряда химических элементов, Астон доказал,
что каждый из этих элементов состоит из различных по массе частиц. Уже первые
опыты, проделанные Астоном в 1920 г. с хлором, показали, что общепринятый
атомный вес хлора 35,45 является лишь средней величиной. При изучении
каналового луча хлора он убедился, что хлор представляет собой смесь 75% атомов
с атомным весом 35 и 25% атомов с атомным весом 37. Дальнейшие исследования
показали, что почти каждый химический элемент состоит из таких неоднородных по
массе атомов, получивших название изотопов.
Так была
обнаружена Астоном линия в спектре, соответствующая изотопу водорода с атомным
весом, равным 2,016, в то время как в течение многих лет вес всех атомов
водорода считался одинаковым и равным 1,008.
В 1932 г.
американские исследователи Юри, Брикведде и Мерфи приступили к поискам этого
тяжелого изотопа водорода.
Они предположили,
что более тяжелые водородные атомы должны быть менее подвижными и поэтому при
испарении жидкого водорода будут скопляться в последних его неиспарившихся
каплях. При изучении этих последних капель испарявшегося водорода Юри,
Брикведде и Мерфи действительно нашли спектральные линии, соответствующие
тяжелому водороду.
Но как получить
тяжелый водород в чистом виде?
Одним из основных
и наиболее распространенных соединений водорода с кислородом на нашей планете
является вода. Вот почему ученые в поисках тяжелого водорода обратились прежде
всего к воде.
Ясно, что
молекула воды, содержащая тяжелый водород, должна испаряться значительно
медленнее, чем молекула обычной воды. Отсюда можно прийти к тому выводу, что
интенсивно испаряющаяся вода должна одновременно обогащаться тяжелым водородом.
Исследования
показали, что вода высыхающих морей (Мертвое море, озеро Эльтон, Байкал,
Каспийское море) действительно содержит небольшое количество тяжелого водорода.
Дальнейшие поиски
источника тяжелого водорода привели к мысли об использовании вод
электролитических ванн. В такие ванны периодически подливают дистиллированную
воду взамен разложенной при электролизе. Американские исследователи Юри и
Уошберн, изучая воду электролитической ванны, убедились в том, что она
значительно тяжелее обыкновенной воды. Удельный вес ее при 4° оказался равном
1,000034.
 |
| Удельный вес тяжелой воды на 0,000034 больше удельного веса обыкновенной воды. |
Исходя из этого,
американцы Льюис и Макдональд задались целью получить при помощи электролиза
воду, состоящую из соединения тяжелого водорода с кислородом. В их опытах
электролиз 3 л воды продолжался несколько недель, причем непрерывно наблюдалось
повышение удельного веса неразложившейся воды. Это было подтверждением того,
что вода непрерывно обогащается тяжелым водородом. Наконец от 3 л осталось
всего 1,5 куб. см воды. При исследовании этих капель ученые убедились в том,
что действительно имеют дело не с обыкновенной водой, а с окисью тяжелого
водорода.
Пять лет назад, в
1933 г., Льюис и Макдональд сообщили миру, что ими получены первые капли новой
воды. Они назвали эту воду тяжелой, так как ее удельный вес был больше
удельного веса обыкновенной воды.
Сообщение Льюиса
и Макдональда о получении тяжелой воды нашло широкий отклик ученых всего мира,
научные журналы всех стран посвятили новой воде множество статей и заметок, а в
научных лабораториях шло кропотливое и упорное изучение природы и свойств вновь
открытого вещества.
Какими же
свойствами обладает тяжелая вода, что нового вносит она в науку?
Полученное
Макдональдом и Льюисом вещество состояло на 99,99% из воды, содержащей тяжелый
изотоп водорода (ученые этот водород назвали дейтерием и стали обозначать
буквой D). Эта вода замерзает при температуре
3,8°, а кипит при температуре 101,420° (при нормальном давлении). Наибольшую
плотность (1,1056) тяжелая вода имеет при температуре 11,6°, в то время как
обычная вода имеет наибольшую плотность при 4°. Пытаясь еще больше увеличить
плотность тяжелой воды, исследователи неожиданно натолкнулись на совершенно
удивительное ее свойство — крайнюю гигроскопичность. Вода гигроскопична! Это
похоже на парадокс, но все же это верно. Новая вода, оказывается, жадно
поглощает влагу. Если ее оставить открытой на несколько часов, то благодаря
жадному поглощению влаги плотность тяжелой воды значительно уменьшится.
 |
| При температуре в 100° тяжелая вода еще не кипит. |
Коэффициент
вязкости (внутреннего трения) является важнейшей физической величиной для
характеристики любой жидкости. Примером жидкости большой вязкости может служить
глицерин, а жидкости малой вязкости — эфир. Исследователей, разумеется,
заинтересовал вопрос, какова же вязкость D2O (так стали обозначать тяжелую воду по
аналогии с простой водой, которую обозначают H2O). Вязкость тяжелой воды оказалась
значительно большей, чем вязкость простой воды. При 20° отношение вязкости
тяжелой к вязкости обычной воды равно 1,249.
Как известно,
способность некоторых растворов проводить электрический ток объясняется
подвижностью ионов. Изучение проводимости растворов тяжелой воды показало, что
подвижность ионов в них гораздо меньше. Таким же образом ученые убедились, что
и растворимость некоторых солей в тяжелой воде значительно меньше, чем в
простой.
Химические
процессы проходят в обычной водной среде с большой скоростью. Они сильно
замедляются в тяжелой воде.
Таким образом,
несмотря на большое сходство с обычной водой, тяжелая вода все же отличается от
нее по своим физическим и химическим свойствам.
Льюис первый
высказал предположение, что тяжелая вода должна быть чрезвычайно вредна для
живых организмов.
Первый опыт
Льюиса заключался в том, что он выбрал двенадцать семян табака и поместил их
попарно в шести одинаковых стеклянных трубках. В первые три он прибавил по 0,02
мг дистиллированной воды, а в остальные три по 0,02 мг тяжелой воды.
Герметически закрытые трубки были установлены в термостат с температурой в 25°.
После двухнедельного пребывания в термостате семена в дистиллированной воде
развились очень хорошо, а семена в тяжелой воде не показали никаких признаков
роста.
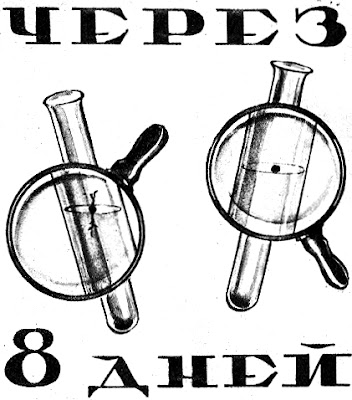 |
| Семена табака, помещенные в тяжелую воду, никаких признаков роста не показали, в то время как семена, помещенные в обыкновенную воду, начали уже нормально развиваться. |
От опытов с
растительными организмами исследователи перешли к опытам с животными
организмами.
Интересно, что
простейшие организмы переносят тяжелую воду в довольно больших количествах,
если в ней есть и обычный водород. Если же весь обычный водород замещен тяжелым
изотопом, то организм погибает. Это объясняется тем, что под влиянием тяжелого
водорода скорость всех физико- и биохимических процессов сильно уменьшается.
Так, например, плоские черви погибали в течение трех часов в 92-процентной
тяжелой воде, а в 30-процентной жили в течение трех дней. Рыба погибала через
два часа после того, как ее помещали в 92-процентную тяжелую воду, а
30-процентная тяжелая вода не вызывала в рыбе никаких видимых изменений.
Все
многочисленные опыты и наблюдения, которые проводились учеными различных стран,
показывают, что тяжелый водород несомненно участвует в физико-химических
процессах, происходящих в организме, причем ход этих процессов зависит от
количества дейтерия и его окиси. Так, например, исследования некоторых ученых
показывают, что гомеопатические дозы тяжелой воды оказывают иногда даже
целебное действие на человеческий организм.
Юри, Брикведде и
Мерфи и другие исследователи установили, что дейтерий присутствует в водах
морей, нефтяных источников, кристаллов, минералов, фруктов. Объясняется это,
очевидно, тем, что в природе непрерывно происходят процессы испарения,
кристаллизации, конденсации и т. д.
Применение
тяжелой воды и тяжелого водорода в химии, физике, биохимии сулит весьма
заманчивые перспективы. Этим и объясняется огромный интерес ученых всего мира к
тяжелой воде. В Советском Союзе тяжелая вода также является предметом
детального изучения целого ряда научно-исследовательских учреждений. В
частности, в Днепропетровском физико-химическом институте работает стационарная
установка, вырабатывающая несколько граммов тяжелой воды в месяц.
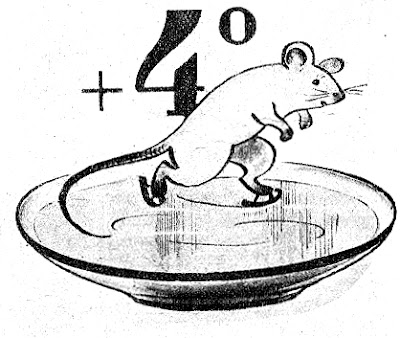 |
| Тяжелая вода замерзает при температуре +4°. |
*
Можно предположить,
что существует сверхтяжелая вода, так как недавно открыт изотоп водорода с
атомным весом 3. Оказалось также, что и второй элемент воды — кислород — имеет
изотопы с разными атомными весами. Найден изотоп кислорода с атомным весом 18,
в то время как обычно в химии принимают атомный вес кислорода равным 16.
Известно, что атомный вес воды складывается из атомных весов двух атомов
водорода и одного атома кислорода. Поэтому соединение тяжелых изотопов
кислорода и водорода может дать воду с атомным весом 24, в то время как атомный
вес обычной воды равен 18. Такая вода, конечно, будет сверхтяжелой. Ее
химическую формулу можно изобразить так: H3H3O18 (цифры вверху
показывают атомные веса элементов, входящих в состав сверхтяжелой воды).
Можно теоретически
заранее предугадать целый ряд свойств такой сверхтяжелой воды. Удельный вес
должен быть равен 1,332; кипеть такая вода будет при 103—105°, а замерзать уже
при 8°. Ее наибольшая плотность будет при 18—20°. Надо полагать, что
характерным свойством сверхтяжелой воды будет сильное уменьшение скорости
всяких химико-физических процессов, протекающих при участии этой новой воды.
Таким образом, мы видим, что свойства воды меняются в зависимости от величины атомного веса ее составляющих — водорода и кислорода. Безусловно, использование свойств новой воды и в химии, и в физике, может многое дать в целом ряде исследовательских работ.






Комментариев нет:
Отправить комментарий